世界各国では感染拡大中の新型コロナウイルス感染症。
日本は緊急事態宣言が解除されて、1日あたりの新規感染者数は1週間平均で110人前後と、かなり落ち着いていますね。
ワクチンの追加接種や新たな変異株など、話題は尽きませんが、今回は新規治療薬候補について紹介したいと思います。
11月10日、日本政府が経口COVID-19抗ウイルス薬モルヌピラビル160万コース分を認可または承認取得後に購入することを発表しました。
経口の治療薬については、ファイザー社のパクスロビドについて以前紹介しました。新型コロナウイルス治療薬の飲み薬、パクスロビドについて調べてみました。 | りんブログ (lynn-pharma.com)
今回はモルヌピラビルについてメルク社のNews releaseの情報をもとに現時点で紹介されている範囲でご紹介します。
モルヌピラビルってどんな薬?
モルヌピラビルは、RNAポリメラーゼを阻害することで抗ウイルス作用を示す薬剤です。
厚生労働省の資料に開発中の治療薬として次の記載がありました。
- 成分名:モルヌピラビル
- 開発企業:MSD
- 分類:抗ウイルス薬(RNAポリメラーゼ阻害薬)
- 開発対象:予防、軽症~中等症Ⅰ(第Ⅲ相)
- 特徴:現在、日本を含む国際共同第Ⅲ相試験を実施中。経口剤。本試験の中間解析において統計的有意差が示されたと発表されている。米国FDAに対してEUA(緊急使用許可)申請をした旨をR3.11.1に公表。
以前紹介したパクスロビドはプロテアーゼ阻害薬であり、モルヌピラビルはパクスロビドと違う作用機序(RNAポリメラーゼ阻害薬)となります。
パクスロビドの時に紹介した コロナウイルスがヒトの体内で増殖する過程 です。
- 体内に侵入後、ヒト細胞膜にスパイクタンパクでくっつき、ウイルスRNAが侵入する
- ウイルスRNAをヒト細胞内のタンパク質合成装置(リポソーム)で翻訳し、複数のウイルスタンパク質つながったものが作られる
- 複数の繋がったウイルスタンパク質の中にタンパク質分解酵素(プロテアーゼ)があり、必要な部分に切り分けられる
- 作られたタンパク質のうちRNAポリメラーゼがウイルスRNAを複製し、増殖する
- 増殖したウイルスは細胞外へ放出され、さらに増殖する。
パクスロビドは3.の部分を阻害することでウイルスの増殖を防ぎます。
一方、モルヌピラビルは4.の部分を阻害することで、ウイルスの増殖を防ぎます。
RNAポリメラーゼ阻害薬で現在新型コロナウイルス治療薬として承認されている薬はレムデシビル(ベクルリー点滴静注用)です。こちらは注射剤であり、中等症Ⅰ~重症の治療に使用されています。モヌルピラビルが承認されれば、中等症Ⅰについてはレムデシビルに変わる薬になるかもしれませんね。
モルヌピラビルの臨床試験
モルヌピラビルの臨床試験については詳細なデータは公表されていませんが、試験の条件や主要評価についてはある程度公表されていましたので、そのデータを紹介します。
MOVe-OUT試験
「新型コロナウイルス感染症(COVID-19)の成人非入院患者を対象にMK-4482を投与した際の有効性、安全性及び薬物動態を評価する第Ⅱ/Ⅲ相二重盲検無作為化プラセボ対照試験」は日本でも実施されたモルヌピラビルの第Ⅱ/Ⅲ相治験です。MOVe-OUT試験と呼ばれています。
臨床研究情報ポータルサイトに掲載されている介入試験の内容は次の通りです。(https://rctportal.niph.go.jp/detail/jr?trial_id=jRCT2031210148#)
- 治験薬:MK-4482(molnupiravir)
- MK-4482のカプセル剤を12時間間隔で5日間(計10回)経口投与
- 治験薬:プラセボ
- MK-4482に対応するプラセボのカプセル剤を12時間間隔で5日間(計10回)経口投与
主要評価項目
- 入院又は死亡した被験者の割合(Day 29まで)
- 入院の定義:原因を問わず病院又は類似の急性期治療施設において24時間以上の急性期治療を行った場合、死亡の定義:原因を問わないすべての死亡)
- 有害事象を発現した被験者の割合(Month 7まで)
- 有害事象の発現により治験薬の投与中止に至った被験者の割合(Day 6まで)
対象患者(主な選択基準)
- 18歳以上の男女
- 無作為割付け前5日以内に採取した検体で検査によりSARS-CoV-2感染が確認された記録が確認できる
- COVID-19に起因する徴候/症状の最初の発現が無作為割付け前5日以内であり、かつ無作為割付け当日にCOVID-19に起因する徴候/症状が1つ以上認められる
- COVID-19の重症度(本治験で規定された基準に基づく)がmild又はmoderateに該当する
- COVID-19の重症化と関連する背景因子又は基礎疾患(本治験で規定された基準に基づく)を1つ以上有する
- SARS-CoV-2に対するワクチン接種を受けていない
試験結果は メルク社のNews releaseの情報 に次のように掲載されています(Deepl翻訳)。
メルクとリッジバック・バイオセラピューティック社、軽度から中等度のCOVID-19を持つ成人を対象とした経口抗ウイルス薬モルヌピラビルのMOVE-OUT試験の結果を発表
MOVe-OUT試験(MK-4482-002)(NCT04575597)は、実験室で確認された軽度から中等度のCOVID-19を持つ入院していない成人患者を対象としたグローバル第3相、無作為化、プラセボ対照、二重盲検、多施設共同試験でした。本試験に登録された患者は、SARS-CoV-2に対するワクチン接種を受けておらず、病気の転帰に関連する危険因子を少なくとも1つ持ち、無作為化前の5日以内に症状が発現していました。MOVE-OUTの主要有効性目標は、プラセボと比較したモルヌピラビルの有効性を、無作為化時点から29日目までに入院および/または死亡した被験者の割合で評価することでした。
MOVE-OUT試験のフェーズ3は、ブラジル、カナダ、チリ、コロンビア、フランス、ドイツ、グアテマラ、メキシコ、フィリピン、ロシア、南アフリカ、スペイン、台湾、ウクライナ、英国、米国などで実施されました。MOVE-OUT試験の詳細については、clinicaltrials.govをご覧ください。 疾患予後不良の最も一般的な危険因子は、肥満、高齢(60歳以上)、糖尿病、心臓病でした。Delta、Gamma、Muの3つの変異体は、中間解析時に解析されたベースラインウイルス変異体の約80%を占めていました。ラテンアメリカ、ヨーロッパ、アフリカでの募集は、それぞれ56%、23%、15%でした。
米ニュージャージー州ケニルワース & マイアミ–(BUSINESS WIRE)–(ビジネスワイヤ) — 米国およびカナダ以外ではMSDとして知られるメルク(NYSE: MRK)とリッジバック・バイオセラピューティクスは本日、COVID-19に対する経口抗ウイルス薬の治験薬であるモルヌピラビル(MK-4482、EIDD-2801)のMOVe-OUT試験の最新情報を発表しました。現在、登録された全被験者(n=1433)のデータが得られています。本試験集団において、モルヌピラビルは、入院または死亡のリスクを、プラセボ群の9.7%(68/699人)からモルヌピラビル群の6.8%(48/709人)に減少させ、絶対リスクの減少率は3.0%(95%信頼区間[CI]:0.1、5.9、名目p値=0.0218)、相対リスクの減少率は30%(相対リスク0.70、95%CI:0.49、0.99)でした。死亡例は、プラセボ群で9例、モルヌピラビル群で1例でした。モルヌピラビルの有害事象プロファイルは、予定されていた中間解析で報告されたプロファイルと一貫していました。
(中間解析での有害事象発生率)あらゆる有害事象の発生率は、モルヌピラビル群とプラセボ群で同等でした(それぞれ35%と40%)。同様に、薬物関連の有害事象の発生率も同等でした(それぞれ12%と11%)。有害事象により試験を中止した被験者は、プラセボ群(3.4%)に比べ、モルヌピラビル群(1.3%)では少なかった。
Merck and Ridgeback Biotherapeutics Provide Update on Results from MOVe-OUT Study of Molnupiravir, an Investigational Oral Antiviral Medicine, in At Risk Adults With Mild-to-Moderate COVID-19 – Merck.com
結果を表にすると次の通りです。
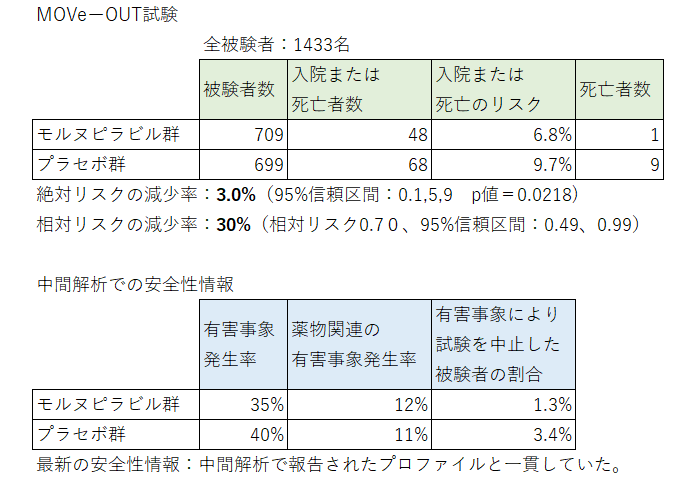
この試験に組み入れられた被験者はワクチン未接種者で18歳以上の男女で基礎疾患がある方です。
MOVe-OUT試験のデータで日本で承認される場合、基本的には基礎疾患のある人が使用対象になりそうです。
有害事象は詳細な情報はありませんが、プラセボ群と同等であるため、大きな問題はないと考えられます。
まとめ
まだ日本で承認されていない薬剤なので詳細は分かりませんが、コロナ治療に飲み薬の抗ウイルス薬が出てくると、入院せずに自宅でも治療できることになります。
感染防止対策は常に実施しながら、新たな治療薬を待ちたいと思います。



コメント